どうも管理人です。製品含有化学物質担当になっちゃった人のための超初級化学講座の13回目です。今回は異性体についてです。異性体は、分子式で書くと同じになる(原子の数と種類が同じ)けど構造が異なる化合物同士のことを言います。
実は、この異性体、製品含有化学物質担当の仕事にはほとんど関係が知識かもしれません。だったら解説いらんだろとなりそうですが、まあ超初級化学講座ということでご勘弁ください。
異性体には種類がある
異性体も、実は色々種類があります。構造異性体とか光学異性体とか配位異性体とかですね。
今回は、その内容を少しだけ解説します。化合物の名前を見た時、知っておいた方がちょっとだけ役に立つときがあるかもしれませんという位のものです。
構造異性体
異性体の中で一番わかりやすいのは構造異性体だろうと思います。これは、分子の中の原子や官能基やその場所が異なるものです。
よく説明されているのは、ブタノールを基本にした例やちょっとこのブログで出てきた化合物としては、フタル酸エステルにもあります。
ブタノールとエーテルの例
以下の構造式を持つ化合物は、すべて同じ分子式C4H10Oを持っているので、分子量はすべて同じになります。
1-ブタノール ![]()
2-ブタノール 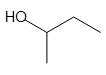
イソブチルアルコール 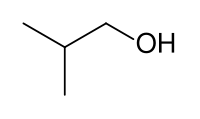
tert-ブチルアルコール 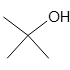
ジエチルエーテル 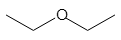
メチルプロピルエーテル ![]()
イソプロピルメチルエーテル 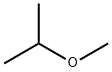
フタル酸エステルの例
以下のフタル酸エステルの分子式は、両方ともC16H22O4になります。
Dibutyl phthalate (DBP)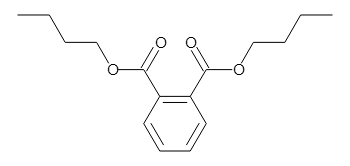
Diisobutyl phthalate (DIBP)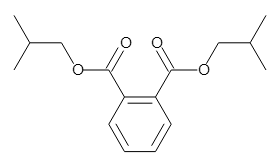
このような構造異性体の場合、その物理的化学的性質は、分子ごとによって異なります。
立体異性体
異性体のもう一つのグループは、通常立体異性体と呼ばれます。
この中にもいくつかあるのですが、今回は二つの例を説明します。
シストランス異性体
これは、分子の立体構造に対して置換基がどの方向についているかで、区別する立体異性体ですが、有名なのは二重結合をもった分子において、置換基がどのようについているかで区別している場合でしょう。
二重結合の平面の同じ側に置換基がついているものをシス(cis)、反対側についているものをトランス(trans)と呼びます。
シストランス異性体で有名なのは、食品・健康系で話題のトランス脂肪酸などと言われているものですね。
以下のオレイン酸(シス)とエライジン酸(トランス)は異性体になります。分子式は両方ともC18H34O2になります。
オレイン酸 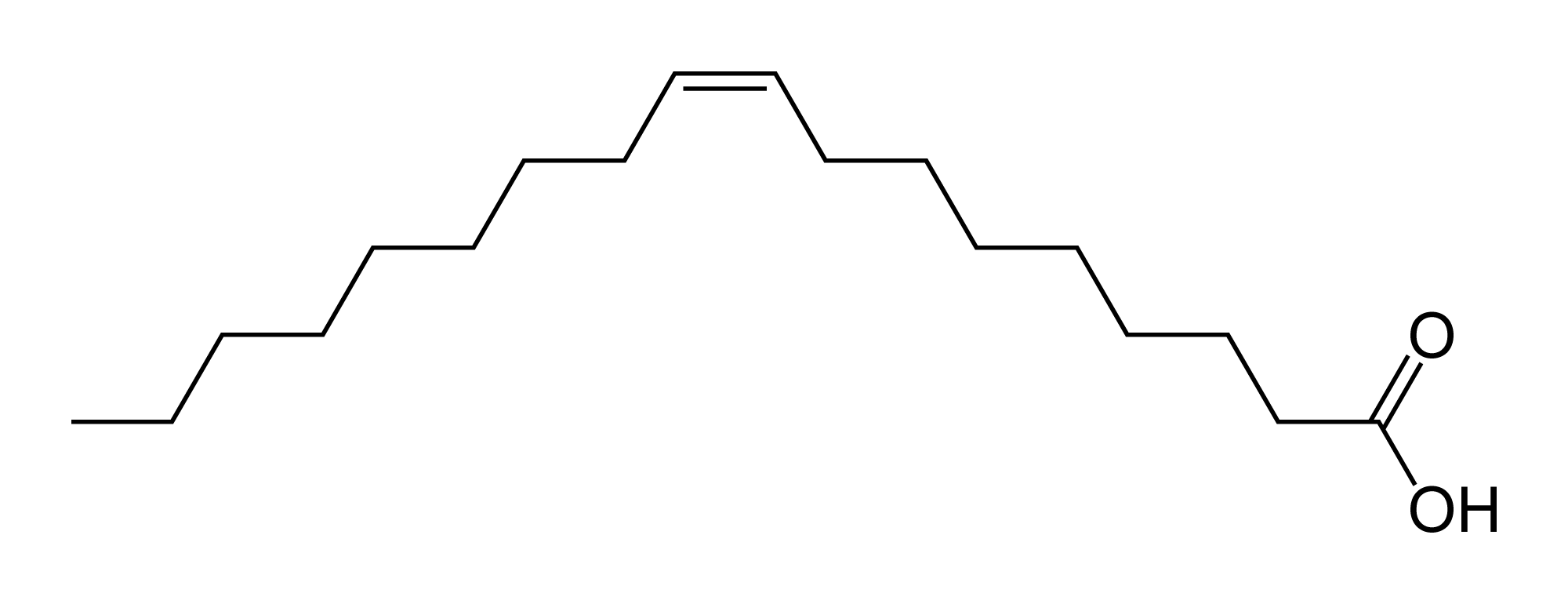
エライジン酸 ![]()
光学異性体
この異性体は、その化合物にキラリティーが有るかないかで決まります。では、キラリティーは何かというと要はその化合物を鏡に映した時、重ならない性質を持つ場合、その化合物は、キラリティーがあると言われます。
ですので、キラリティーが有る化合物は、その化合物を鏡に映した構造を持っている、異性体があるはずです。
有名な例としては、アスパラギン酸があります。L-アスパラギン酸は、以下のような構造をしています。
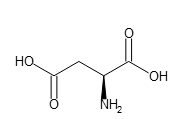
この図において、NH2は画面の手前に飛び出しているような構造を表しています。このNH2の結合している炭素は、4本の結合手にすべて異なる置換基がついているために、鏡面構造の分子は元の分子と重ね合わすことができません。
このような異性体を今はあまり推奨された呼び方ではないようですが、光学異性体と言います。
異性体の種類はその他にもある
異性体の種類は、他にもあるのですが今回は割愛します。何でかって?それこそ製品含有化学物質担当には、ほとんどと言っていいほど必要ないし、管理人が説明するのが大変だからです。
それと東京オリンピックの期間(2021年7月22日から8月8日)は、当ブログも更新頻度がかなり少なくなると思いますのでよろしくお願いします。
その後のお盆の時期は、今年は記事を出していくつもりです。


コメント